Содержание
Солевые полоскания
Солевой раствор можно отнести к одним из наиболее популярных средств для полоскания при боли или воспалении в горле. Его эффективность обусловлена способностью предотвращать пересыхание слизистой оболочки глотки и миндалин, и таким образом препятствовать образованию микротрещин, а также дальнейшему развитию воспалительного процесса .
Положительный эффект дает полоскание морской водой. В отличие от раствора натрия хлорида, морская вода оказывает некоторое антисептическое действие за счет содержания йода. К тому же в ее состав входят микроэлементы, способствующие укреплению местного иммунитета, такие как цинк и селен.
Гипертонические растворы оказывают осмотическое и тканевое давление на микрофлору, вследствие чего нарушается функция клеточных мембран и бактерии погибают. Не следует сбрасывать со счетов и возможность солевых растворов механически смывать возбудителей инфекции с миндалин и задней стенки глотки .
Полоскание солевыми растворами рекомендуют назначать при боли в горле не только отечественные, но и западные специалисты . Раствор натрия хлорида и морская вода помогают уменьшить выраженность легкой и умеренной боли в горле, однако при сильном болевом синдроме, согласно международным рекомендациям по лечению боли в горле, следует сочетать его с приемом анальгетиков, таких как парацетамол и ибупрофен .
Кстати, вполне можно предложить посетителю, которого тревожит сильная боль в горле, сочетать полоскание с приемом безрецептурных НПВП. Таким образом, получаем уместную и «клинически обоснованную» допродажу ЛС.
Необходимо подчеркнуть, что растворы натрия хлорида или морской соли — оптимальная рекомендация, если нужно определиться со средством для полоскания горла именно для детей, т. к. возрастных ограничений нет: главное, чтобы ребенок уже умел выполнять эту процедуру. К тому же солевые растворы для полоскания помогают не только облегчить боль в горле, но и проявляют профилактический эффект в отношении возбудителей респираторной инфекции.
По данным исследований японских ученых с участием более 19 500 детей 2–6 лет, полоскания горла раствором соли, зеленым чаем и даже водопроводной водой по крайней мере один раз в день снижали вероятность ОРВИ и лихорадки при ОРВИ .
В ассортименте аптек солевые растворы в основном представлены в спреях для орошения. Для полоскания можно предложить раствор натрия хлорида изотонический, стерильный для инфузий или остановить выбор на порошках. Как правило, они содержат еще и йод, экстракты растений и другие ингредиенты.
Особенности технологии приготовления электролита
При самостоятельном приготовлении следует помнить следующее:
- плотность кислоты и щелочи намного выше плотности воды;
- реакции смешивания кислоты с водой и растворения щелочи происходят с выделением высокой температуры (до 80-90°С);
- кислоты и щелочи взаимодействуют с большинством металлов.
Из перечисленного следует, что посуда для приготовления электролита должна быть из материала, стойкого к действию агрессивных веществ и температуры. Наиболее соответствует этим требованиям посуда из стекла и керамики. Использование пластиковой посуды возможно при условии недопускания ее нагрева до высоких температур. Нельзя использовать эмалированную посуду, поскольку при наличии незаметных трещин в эмали будет происходить загрязнение электролита солями металлов. То же самое относится к изделиям из нержавеющей стали. Такие материалы не вступают в реакцию с водой, но производители не гарантируют ее нейтральность по отношению к агрессивным веществам.
Приготовление кислотного электролита
Высокая плотность кислоты и способность разогрева при смешивании с водой обусловили специфику приготовления раствора: кислоту нужно вливать в воду. Если поступить наоборот, то вода, оказавшись сверху, нагреется до температуры закипания и выплеснется наружу вместе с каплями кислоты.
Чтобы уменьшить нагрев, кислоту целесообразно разбавить в два этапа. На первом готовится раствор плотностью 1.40, а затем, после остывания, делают электролит необходимой концентрации. Раствор с плотностью 1.40 называют корректирующим. Он применяется для коррекции плотности электролита в рабочих аккумуляторах. После добавления кислоты в воду смесь аккуратно перемешивают стеклянной палочкой. Приготовленный электролит необходимо оставить на некоторое время (от половины до суток) для его равномерного смешивания и полного остывания.
Приготовление щелочного электролита
Необходимое количество щелочи высыпают в отмеренное количество воды и перемешивают до полного растворения. Также необходимо выдержать время, пока осадок не растворится полностью и температура не опустится до нормальной.
Раствор щелочи нужно хранить в герметично закрытой таре, не допуская попадания воздуха. Углекислый газ легко вступает в реакцию со щелочами с образованием карбонатов – солей угольной кислоты. В результате содержание активного вещества в растворе с течением времени падает.
Растворы кислоты и щелочи должны быть прозрачными или иметь легкий желтоватый оттенок. Наличие мутности отстоявшегося раствора говорит о низкой чистоте исходных компонентов и для использования в аккумуляторах непригодны.
Инструкция
Есть противники и сторонники применения такого агрессивного способа удаления засора. Опасения понятны, особенно они касаются жителей многоквартирных домов, где если не в доме, то в подвалах сохранились еще чугунные участки канализации, которые разрушаются под действием соляной кислоты. Вместо прочистки получается протечка. Но такой исход зависит от концентрации.
Реагент содержится в каждом химическом препарате, применяемом в быту для чистки канализации, которыми пользуются все, не соблюдая при этом мер предосторожности. Логично использовать соляную кислоту в качестве самостоятельного средства очистки, соблюдая пропорции
По своему химическому составу она может растворять многие материалы, а также кислота выделяет тепло, расщепляющее жировые наслоения.
Если кислоту использовать строго по правилам, соблюдая при этом предосторожность, то многие опасения отпадут

При работе с кислотой следует использовать защитные средства: резиновые перчатки, очки, прорезиновый фартук, в идеале противогаз. Перед началом работы рекомендуется открыть окна, увеличить приток воздуха.
Очередность действий:
- Закрыть сливные отверстия в сантехнических установках;
- Разбавить концентрацию кислоты водой, довести до уровня максимум 10 %. При жёстких засорах процентное содержание допустимо увеличить. К тому же следует иметь в виду, что в сливных отверстиях всегда присутствует вода, при соприкосновении с которой концентрация сразу падает;
- Залить в сливное отверстие тонкой струйкой, не допуская разбрызгивания по сторонам;
- Количество раствора должно соответствовать величине проблемы. При глухом засоре кислота должна проникнуть по трубе максимально дальше;
- Сливное отверстие прикрыть любым предметом, который перекроет распространение кислотных паров, выдержать время в пределах двух часов, минимум 30 минут;
- Промыть водой, опробовать результат. При необходимости процедуру допустимо повторить в той же последовательности.
Соляная кислота может избавить от любых засоров, которые не удалось устранить иными способами. Она проста в применении к любому стоку, нет необходимости привлекать механические средства
Обязательно соблюдать меры предосторожности, как и при других химических способах, применяемых для чистки канализации
Применение в медицине
В мед. практике С. к. согласно ГФХ применяется под названием «кислота хлористоводородная».
Кислота хлористоводородная (Acidum hydrochloricum, син. кислота соляная; ГФХ, сп. Б) — бесцветная прозрачная летучая жидкость со своеобразным запахом и кислым вкусом; плотность 1,122 — 1,124. Наружно используют 6% р-р к-ты хлористоводородной для лечения чесотки (см.) по методу Демьяновича. Для приема внутрь применяют только к-ту хлористоводородную разведенную (Acidum hydrochloricum dilutum; ГФХ, сп. Б), к-рая содержит 1 ч. к-ты хлористоводородной и 2 ч. воды. Содержание HCl в ней 8,2—8,4%, плотность 1,038—1,039.
К-та хлористоводородная разведенная используется для заместительной терапии при различных заболеваниях. Так, при недостаточной секреторной функции желудка ее применяют с целью создания оптимальных условий для действия желудочных протеолитических ферментов, а также для улучшения регуляции перехода содержимого желудка в двенадцатиперстную кишку. При попадании в двенадцатиперстную кишку к-та хлористоводородная разведенная стимулирует выделение секретина, к-рый способствует выделению сока поджелудочной железы. Однако в средних терапевтических дозах к-та хлористоводородная разведенная при приеме ее с пищей не позволяет создать оптимальных условий (pH ок. 2,0) для действия пепсина (см.) у больных с выраженной недостаточностью желудочных желез. Кроме того, у таких больных ослаблен механизм возбуждения секреторной активности поджелудочной железы в ответ на попадание к-ты хлористоводородной в двенадцатиперстную кишку. Поэтому к-ту хлористоводородную разведенную следует комбинировать с другими средствами заместительной терапии при недостаточности желудочных желез и поджелудочной железы.
При декомпенсированных формах хрон. атрофического гастрита с секреторной недостаточностью (ахилия, ахлоргидрия), иногда для улучшения аппетита у истощенных и ослабленных больных, страдающих ахлоргидрией, а также при железодефицитных анемиях к-ту хлористоводородную разведенную назначают вместе с препаратами железа для улучшения их всасывания и усвоения в организме.
Кислоту хлористоводородную разведенную, часто вместе с пепсином, с целью заместительной терапии назначают внутрь взрослым по 10—15 капель на 1/4—1/2 стакана воды 2—4 раза в день во время еды (рекомендуют этот р-р пить через соломинку или полиэтиленовую трубочку во избежание разрушающего действия С. к. на зубы); детям до 1 года дают по 1 капле, от 2 до 5 лет — по 2—5 капель, от 6 до 12 лет — по 5—10 капель на прием. Высшие дозы для взрослых внутрь: разовая 2 мл (40 капель), суточная 6 мл (120 капель).
Противопоказанием к применению к-ты хлористоводородной разведенной являются язвенная болезнь желудка и двенадцатиперстной кишки, симптоматические или медикаментозные пептические язвы желудка, эрозивный и эрозивно-язвенный гастрит, пептическая язва пищевода, рефлюкс-эзофагит.
Форма выпуска: во флаконах по 80 мл.
Хранят в склянках с притертыми пробками.
См. также Кислоты и основания.
Библиография: Вольфкович С. И., Егоров А. П. и Эпштейн Д. А. Общая химическая технология, т. 1, с. 491 и др., М.—Л., 1952; Вредные вещества в промышленности, под ред. Н. В. Лазарева и И. Д. Гадаскиной, т. 3, с. 41, Л., 1977; Некрасов Б. В. Основы общей химии, т. 1 — 2, М., 1973; Неотложная помощь при острых отравлениях, Справочник по токсикологии, под ред. С. Н. Голикова, с. 197, М., 1977; Основы судебной медицины, под ред. Н. В. Попова, с. 380, М.—Л., 1938; Радбиль О. С. Фармакологические основы лечения болезней органов пищеварения, с. 232, М., 1976; Рем и Г. Курс неорганической химии, пер. с нем., т. 1, с. 844, М., 1963; Руководство по судебно-медицинской экспертизе отравлений, под ред. Р. В. Бережного и др., с. 63, М., 1980.
Н. Г. Будковская; Н. В. Коробов (фарм.), А. Ф. Рубцов (суд.).
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Формула Соляной Кислоты в химии: HCl. В молекуле атомы водорода соединяются с атомами галогена – Cl. Если рассмотреть электронную конфигурацию этих молекул, то можно отметить, что в образовании молекулярных орбиталей соединения принимают участие 1s-орбитали водорода и обе 3s и 3p-орбитали атома Cl. В химической формуле Соляной Кислоты 1s-, 3s- и 3р-атомные орбитали перекрываются и образуют 1 , 2 , 3 -орбитали. При этом 3s-орбиталь не носит связывающий характер. Наблюдается смещение электронной плотности к атому Cl и снижается полярность молекулы, но увеличивается энергия связи молекулярных орбиталей (если рассматривать ее в ряду с другими галогеноводородами).
Физические свойства хлористого водорода. Это прозрачная бесцветная жидкость, обладающая способностью дымиться при соприкосновении с воздухом. Молярная масса химического соединения = 36,6 грамма на моль. При стандартных условиях, при температуре воздуха 20 градусов Цельсия, максимальная концентрация вещества составляет 38% по массе. Плотность концентрированной хлороводородной к-ты в такого рода растворе составляет 1,19 г/см³. В целом же, физические свойства и такие характеристики, как плотность, молярность, вязкость, теплоемкость, температура кипения и pН , сильно зависят от концентрации раствора. Эти величины подробнее рассматриваются в таблице плотностей. Например, плотность Соляной Кислоты 10% = 1,048 кг на литр. При затвердевании вещество образует кристаллогидраты разных составов.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует хлорид натрия и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. Карбонат кальция и карбонат натрия будут образовывать после реакции с HCl хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца, перманганатом калия: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O. Вещество реагирует с аммиаком, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца: MnO2+4HCl=Cl2+MnO2+2H2O (реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра выпадает белый осадок хлорида серебра и образуется азотная к-та. Уравнение реакции взаимодействия метиламина с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl.
Вещество реагирует со слабым основанием анилином. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин (хлорид фениламмония): (С6Н5NH3)Cl. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3. Уравнение реакции карбоната калия с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.
А может, это кальциноз?
Иногда в суставах происходят патологические процессы, связанные непосредственно с нарушением солевого обмена. Кальциноз – это отложение в тканях и органах солей кальция из-за сбоев в работе паращитовидных желез. Другие причины – заболевания костей, почек, гипервитаминоз Д.
Различают две разновидности болезни:
- метаболический кальциноз развивается из-за местного нарушения метаболизма в тканях, при этом соли откладываются в мышцах, коже и подкожно-жировой клетчатке;
- метастатический – вызван высокой концентрацией соли в крови (гиперкальциемия), поэтому они откладываются на стенках сосудов и во внутренних органах.
Если концентрация солей в организме нормальная, они растворены в жидкости и участвуют в разных процессах. При перенасыщении – осаждаются в органах и тканях, на зубах и в сосудах, образуя выросты величиной от небольших горошин до образований с грецкий орех. Наиболее распространенные места локализации – кисти рук, локти, нижние конечности, ушные раковины, спина, ягодицы и крупные суставы.
Подобные участки с «отложением солей» подвижные и плотные на ощупь, а их пальпация не вызывает у человека боли, за исключением плечевого сустава. Кожа над ними вытягивается и приобретает синий оттенок, однако воспаление отсутствует. Со временем образования становятся мягче, из них выделяются белесые крупинки – известь, которая и помогает поставить диагноз «кальциноз».
Кальциноз в плечевом суставе всегда сопровождается болью
Получение кислоты в домашних условиях
Попробуем получить щёлочь или кислоту в домашних условиях с помощью подручных средств.
Конечно, полученный нами препарат не будет концентрированным (это достигается с помощью
специального оборудования), но характерные свойства кислоты обязательно будут заметны.
Наиболее простой способ получение кислоты в домашних условиях будет основан на электролизе какого-либо раствора, который диссоциирует с образованием сульфат-иона. Иным способом получить кислоту тоже можно, но это связано или с получением сернистого ангидрида, или других химических препаратов, которых может не оказаться, да и все они достаточно опасны, чтобы с ними работать дома.
Поэтому, получим, например, серную кислоту (разбавленную) из медного купороса. Та концентрация, которая получается из купороса — особо не опасна, к тому же, средств для её получения нужно немного.
Итак, для опыта нам необходим источник
тока (отлично подойдёт блок питания от 15 до 30 вольт). Анод (электрод подключаемый к плюсу)
будем брать графитовый, — чтобы не растворялся. Катод – лучше взять виде графитовой пластинки,
но можно также использовать медную фольгу.
Разведите раствор купороса опустите в него электроды. На катоде будем наблюдать выделение
бурого рыхлого вещества – это медь.
Что такое медный купорос? Это медь, растворённая в серной кислоте. Приготовьтесь периодически
вынимать катод » — » и очищать его от выделившейся на нём меди. Чем дольше продолжается опыт,
тем раствор нашего электролита становится всё более светлым – из него удаляется медь. Если
опустить наш индикатор в посветлевший раствор, то окраска изменится на алый цвет. Как-никак
серная кислота! Конечно, она сильно разбавленная, но всё же проявляет свои свойства.
Для того, чтобы более удостовериться в полученной кислоте возьмите пищевую соду и капните на неё
полученной кислотой, — при этом должно наблюдаться бурное выделение газа – это углекислый газ.
Серная кислота вступает в реакцию с пищевой содой, образуя при этом соль натрия (Na2SO4), воду и
пузырьки углекислого газа.
Задуманное получилось! Для некоторых веществ она слабовата (т.к. сильно разбавлена) и реакции с
ними Вы наблюдать не будете.
Конечно, можно увеличить концентрацию кислоты, если растворить в воде больше медного купороса
или выпариванием излишка воды в полученной кислоте. Последнее проделывать не рекомендую, т.к.
пары кислоты очень опасны.
- HCl — pH=1,0
- CCl3COOH — pH=1,2
- H2C2O2 — pH=1,3
- NaHSO4 — pH=1,4
- Винная кислота — pH=2,0
- Лимонная кислота — pH=2,1
- Молочная кислота — pH=2,4
- Салициловая кислота — pH=2,4
- Янтарная кислота — pH=2,7
- C6H5COOH — pH=2,8
- CH3COOH — pH=2,9
- NH4H2PO4 — pH=4,0
- H2S — pH=4,1
- NaH2PO4 — pH=4,5
- KH2PO4 — pH=4,7
- HCN — pH=5,1
- NH4Cl — pH=5,1
- H3BO3 — pH=5,3
- (NH4)2SO4 — pH=5,5
- Фенол — pH=5,5
- CaCO3 — pH=7,3
- (NH4)2HPO4 — pH=7,9
- C6H5COONa — pH=8,0
- NaHCO3 — pH=8,3
- CH3COONa — pH=8,9
- Na2HPO4 — pH=9,2
- Mg(OH)2 — pH=10,0
- KCN — pH=11,1
- NH3 — pH=11,3
- Na2CO3 — pH=11,6
- Na3PO4 — pH=12,0
- Ca(OH)2 — pH=12,4
- Na2SiO3 — pH=12,6
- K2S — pH=12,8
- NaOH — pH=13,0
Какая кислота кислее?!
Наверное, Вы когда-нибудь задавали вопрос «какая же из кислот более кислая ?!» «или какая из щелочей более едкая ?!»
На этот вопрос можно ответить, рассмотрев значения pH растворов кислот и щелочей. Кислот очень много, поэтому рассмотрим лишь самые основные.
Значение рН раствора зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Чем меньше значение pH раствора, тем кислота «кислее» и наоборот, чем больше значение pH раствора, тем более едкая щелочь!
Получается, что, если выпить концентрированный лимонный сок, кислотность желудочного сока… понизится !? Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.
Устройство солевого бака
Все реагентные баки устроены примерно одинаково. Солевой бак устроен очень просто:
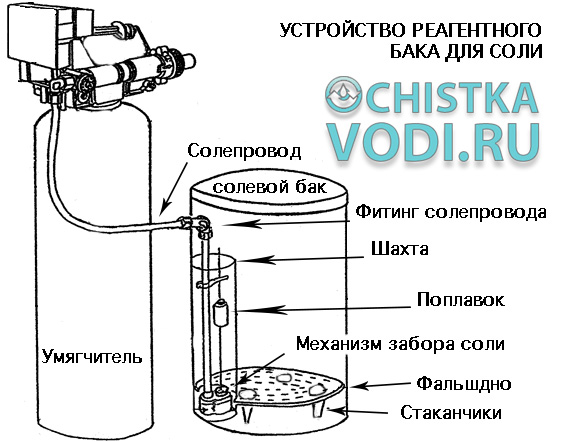 Солевой бак представляет собой емкость любой формы и размера, внутри которой находится фальшдно, на которое ложится соль.
Солевой бак представляет собой емкость любой формы и размера, внутри которой находится фальшдно, на которое ложится соль.
Фальшдно перфорированное и сквозь него спокойно проникает вода. Это позволяет растворять всю соль полностью без остатка.
Стаканчики выполняют роль опоры и дополнительно помогают растворять остатки соли.
Механизм солевого бака находится в пластиковой шахте, отделяющей механизм от таблетированной соли.
Механизм представляет собой двухходовой кран, перекрывающий солепровод как при опускании уровня жидкости до нижней отметки (2 см над дном), так и перекрывает солепровод на подачу воды при подъеме поплавка (отсечка по верхнему уровню).
Солевые баки полностью выполнены из пластика, что делает их устойчивыми к агрессивному солевому раствору, благодаря чему солевые баки имеют очень большой срок службы — 10 и более лет.
Производство
Соляную кислоту обычно получают промышленным способом путем растворения хлористого водорода в воде. Хлористый водород может быть получен разными способами, и, таким образом, существует несколько предшественников соляной кислоты. Крупномасштабное производство соляной кислоты почти всегда интегрируется с промышленным производством других химикатов , например, в хлорно-щелочном процессе, который производит гидроксид , водород и хлор, последний из которых может быть объединен для получения HCl.
Промышленный рынок
Соляная кислота выпускается в растворах с содержанием HCl до 38% (концентрированная)
Химически возможны более высокие концентрации до чуть более 40%, но при этом скорость испарения настолько высока, что при хранении и обращении требуются дополнительные меры предосторожности, такие как создание давления и охлаждение. Таким образом, массовая продукция промышленного класса составляет от 30% до 35%, что оптимизировано для обеспечения баланса между эффективностью транспортировки и потерями продукта из-за испарения
В Соединенных Штатах растворы от 20% до 32% продаются как соляная кислота. Растворы для бытовых целей в США, в основном для очистки, обычно составляют от 10% до 12%, при этом настоятельно рекомендуется разбавлять их перед использованием. В Соединенном Королевстве, где он продается как «Солевой спирт» для бытовой химии, его эффективность такая же, как у промышленного сорта США. В других странах, таких как Италия, соляная кислота для бытовой или промышленной очистки продается как «Acido Muriatico», и ее концентрация колеблется от 5% до 32%.
Основные мировые производители включают Dow Chemical с производительностью 2 млн метрических тонн в год (2 млн тонн в год) в пересчете на газ HCl, Georgia Gulf Corporation , Tosoh Corporation , Akzo Nobel и Tessenderlo с объемом производства от 0,5 до 1,5 млн тонн в год каждая. Общее мировое производство, в целях сравнения, выраженное в HCl, оценивается в 20 Мт / год, из которых 3 Мт / год — за счет прямого синтеза, а остальное — как вторичный продукт в результате органического и аналогичного синтезов. Безусловно, большая часть соляной кислоты потребляется производителем самостоятельно. Объем открытого мирового рынка оценивается в 5 млн т / год.
Соляная кислота Факты
Хлористый водород – это соединение, состоящее из соотношения водорода и хлора один к одному., Без присутствия молекул воды хлористый водород является бесцветным, но токсичным газом. При добавлении воды водород высвобождает многие из своих молекул водорода с образованием сильнокислого раствора. Чуть более 97% молекулярной массы HCl приходится на один хлорид-ион. Этот хлорид-ион имеет атомную массу 35,543, а ион водорода – атомную массу 1,00794. Поскольку имеется только один атом каждого, молярная масса HCl рассчитывается путем сложения этих двух цифр – 36,46094 г / моль. Как уже упоминалось, формулой хлористого водорода является HCl.
В случае молекулярной массы результаты зависят от количества молей HCl. Например, в растворе, где имеется достаточное количество атомов хлористого растворенного газа (Cl2) для числа атомов молекулярного водорода (H2), мы можем с уверенностью сказать, что 4 моля HCl будут давать 4,00 моль HCl.
Используя уравнение Масса HCl = Моль HCl х Молярная масса HCl, мы можем определить, что 4,00 моль х 36,46 г моль-1 составляет 146 г.
Плотность соляной кислоты, pH, температура плавления и температура кипения зависят от концентрации. Например, 10% раствор HCl имеет плотность 1048 кг / л, pH -0,5, температуру плавления -18 ° C и температуру кипения 103 ° C. 30% раствор HCl имеет плотность 1,149 кг / л, pH -1, температуру плавления и кипения -52 ° C и 90 ° C соответственно.
Расчет реагентного (солевого) бака
Размер реагентного бака для перманганата калия (марганцовки) всегда стандартный — 25л, а вот размер солевого бака подбирается под объем смолы. Чем больше умягчитель — тем больше берут и солевой бак.
Для колонн 0844-1354 берут обычно солевой бак объемом 70 литров. Однако, можно применять и солевой бак объемом 100 литров для умягчителей небольшого размера, в таком случае запас соли будет больше.
Для регенерации различных ионообменных смол рекомендует от 70 до 150 гр соли на литр смолы на одну регенерацию. Читайте инструкцию на Вашу смолу — там есть рекомендованный расход реагента.
Известно, что соль растворяется в воде в пропорции 300гр соли на 1 литр воды до получения насыщенного солевого раствора. В дистиллированной воде растворяется 350 гр соли на литр, но мы занимаемся умягчением воды, а это значит, что водичка у нас далеко не дистиллированная! Она уже довольно много всего в себе содержит и не является таким крутым растворителем, как дистиллированная вода. Насыщенная вода перестает растворять соль. Это очень удобно для регенерации смолы. Мы наливаем в солевой бак нужное количество воды и несмотря на то, что бак полон соли — приготавливается нужное количество раствора, а нерастворенная соль остается для последующих регенераций.
Таким образом мы считаем:
- Количество соли для регенерации (кг) = количество смолы (литров) х 120 гр (для катионитов)
- Количество воды в солевом баке (л) = количество соли для регенерации (гр) / 300 (гр)
Полезные советы эксплуатации
- Насыпайте в солевой бак 1 мешок соли, не заводите привычку заполнять солевой бак полностью. Потому что под большим весом мокрые солевые таблетки раздавливаются и порошок соли скапливается на дне бака и плохо растворяется. Это приводит к засорам и солевым мостам.
- Перед каждом добавлением очередного мешка соли удаляйте мусор из солевого бака, не допускайте попадания песка, строительной пыли, ошметков от мешков в солевой бак.
- Делайте полную чистку солевого бака при каждом годовом обслуживании системы водоочистки
- Проверяйте иногда герметичность солепровода — хорошо ли затянута цанга.
- Используйте только качественную таблетированную соль
- Наклон солевой бак на бок — можно увидеть уровень воды в солевом баке, когда уровень соли выше уровня воды.
- Посмотреть уровень воды под толщей соли можно так же сквозь шахту поплавкового механизма, если снять с него крышечку
Если у Вас остались вопросы по солевым бакам, умягчителям — Вы можете писать мне на почту samopalych@yandex.ru или на WhatsApp +79262187875 консультации бесплатны.
Продукты, повышающие кислотность желудка
По сравнению с меню для высокого кислотно-щелочного баланса, здесь в диету можно включать:
- цитрусовые;
- квашенную капусту;
- продукты с витамином C;
- бобовые;
- кисломолочные;
- полужидкую гречневую, рисовую, пшеничную, овсяную каши;
- лечебные столовые воды.
Пониженная кислотность желудка лечится с добавлением витаминных и минеральных добавок.
Авитаминоз
Пища, как уже говорилось, от недостатка кислоты плохо переваривается и не до конца усваивается, поэтому большинство витаминов и микроэлементов проходят «транзитом». В результате развивается их дефицит, что приводит к снижению иммунитета, хрупкости сосудов и т. д.
Как повысить кислотность в организме, народный метод: уксус для повышения кислотности
«Подкислить» организм поможет яблочный уксус — источник чистой яблочной кислоты. Наиболее безобидный рецепт — ежедневно во время завтрака выпивать стакан воды с чайной ложной уксуса. Но предварительно стоит проконсультироваться с врачом, поскольку уксус имеет ряд противопоказаний (воспаление слизистой оболочки желудка и кишечника, болезни печени, почек и т. д.).
Как определить: повышенная или пониженная кислотность желудка?
Существуют медицинские и народные методы. Проверить баланс рН дома, не посещая клиники, можно следующими способами:
- съесть дольку лимона – слишком кислый вкус свидетельствует о высоком pH, если вкус показался нейтральным – о низком;
- развести пол-ложки соды в 200 мл теплой воды – скорая отрыжка говорит о повышенной кислотности, запоздалая или отсутствие отрыжки – о пониженной.
Домашний тест на кислотность желудка не гарантирует 100% верные результаты. Стоит подкрепить диагноз диагностикой.
Как определить кислотность желудка диагностикой?
При подозрениях на гастрит, язву, проблемы с уровнем pH, врачи отправляют пациента обследоваться:
- провести зондирование;
- сдать крови на анализ;
- сделать лакмусовый тест или ацидотест.
Определить кислотность желудка в домашних условиях можно через мочу и слюну – для этих целей продаются специальные тест-полоски. Результаты расшифровываются самостоятельно, к полоскам прикладывается инструкция.
Наши эксперты:
- Наталья Гордиенко, терапевт-гастроэнтеролог
- Галина Арвахи, консультант по питанию, фитнес-тренер






